2022年7月,中山大学附属肿瘤医院和中山大学数学学院联合在Science Advances杂志发表了题为 Interrogating glioma-M2 macrophage interactions identifies Gal-9/Tim-3 as a viable target against PTEN-null glioblastoma的文章,发现PTEN缺失胶质瘤免疫治疗新靶点。已有文献报道,PTEN缺陷的胶质瘤可以募集大量的巨噬细胞于胶质瘤微环境中【6】。与文献报道一致,本研究也证明了胶质瘤发生PTEN缺失后,募集巨噬细胞的能力显著增强。重要的是,研究者的实验结果证明,PTEN缺失的胶质瘤诱导巨噬细胞发生M2极化的能力显著强于PTEN野生型胶质瘤。PTEN缺失的胶质瘤如何诱导巨噬细胞M2型极化呢?研究者发现,PTEN缺失胶质瘤可能分泌了某些细胞因子诱导巨噬细胞M2极化,为了进一步探究哪种分泌蛋白可能诱导巨噬细胞M2极化,他们分析了LN229细胞PTEN敲除前、后编码分泌蛋白的基因表达倍数的改变。根据分泌蛋白数据,筛选出LN229细胞中PTEN-KO/PTEN-WT的mRNA比值超过1倍的潜在与巨噬细胞募集、极化相关的细胞因子。接着,结合条件培养基的蛋白芯片分析以及分子生物学分析,筛选出PTEN缺失胶质瘤细胞可以分泌Galectin9(Gal-9)蛋白于微环境中进而调节巨噬细胞M2极化。中山大学数学院孙小强团队,基于自主开发的细胞通讯多层网络建模方法【7,8】,分析了PTEN缺失型与野生型GBM组织的单细胞转录组测序数据,揭示了配体Gal-9及其受体Tim-3介导了胶质瘤-巨噬细胞的共生性相互作用;他们发现,与PTEN野生型胶质瘤比较,PTEN缺乏的胶质瘤具备独特的富含巨噬细胞的肿瘤微环境。Gal-9配体激活巨噬细胞上的Tim-3受体后,可以引起M2型极化相关的转录因子发生激活,并导致巨噬细胞的迁移、活化、及巨噬细胞相关的血管生成通路在PTEN-null胶质瘤中富集。为了搞清楚胶质瘤细胞PTEN缺失后调节Gal-9高表达的具体分子机制,针对LN229细胞敲除PTEN前、后的RNA-seq数据,作者进一步通过通路富集分析预测了PTEN缺失可能调节了哪些信号通路,结果表明,在PTEN缺失的胶质瘤细胞中,活化的AKT通路通过促进GSK-3β的Ser9位点磷酸化使之失活,从而减少GSK-3β介导的IRF1降解,进而导致转录因子IRF1被上调,大量IRF1进入细胞核后促进LGALS-9基因转录及Gal-9的表达。研究者发现,CGGA、TCGA、GEO数据库及中肿神经外科的临床标本及生存分析结果均提示, 高表达的Gal-9/Tim-3信号与间充质型胶质瘤密切相关,并且预示胶质瘤患者预后不良。那么,阻断Gal-9/Tim-3是否可以提高胶质瘤预后呢?如何打破PTEN缺失的胶质瘤细胞与巨噬细胞间的共生性相互作用呢?研究者们发现,anti-Tim3抗体及Gal-9的抑制剂显著延长了PTEN缺失胶质瘤小鼠、大鼠模型的生存时间,并且显著抑制了巨噬细胞M2极化,表现为CD163阳性的巨噬细胞比例下降。因此,Gal-9/ Tim-3是治疗PTEN缺失胶质瘤的有效靶点,阻断Gal-9/ Tim-3可以通过抑制巨噬细胞M2极化从而抑制胶质瘤恶性进展。鉴于已经知道肿瘤相关巨噬细胞有免疫抑制和血管生成作用,寻找更容易对巨噬细胞为靶点的治疗策略起反应的某种分子特征的胶质瘤,筛选出这类型胶质瘤的分子分型特征,将具有重要的临床意义。重要的是,研究者发现PTEN缺乏可通过激活PI3K-AKT通路上调GBM细胞的Gal-9分泌,这为GBM对CSF1R抑制剂等其他巨噬细胞为靶点的治疗策略产生耐药,提供了一种新的分子层面的解释。
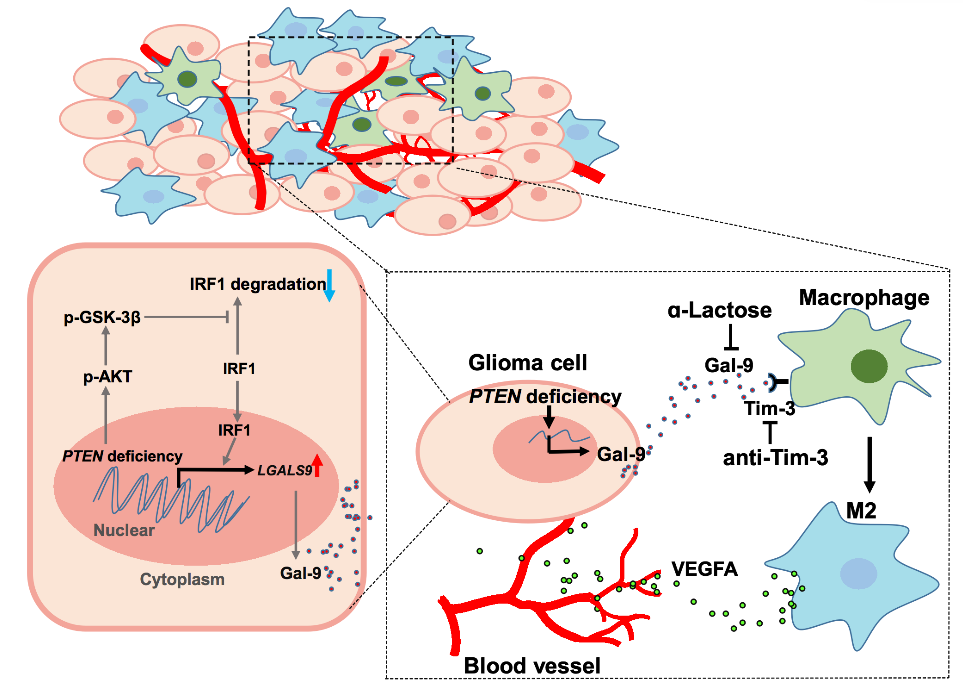
Gal-9/Tim-3信号介导了PTEN缺失胶质瘤-M2型巨噬细胞间的共生性交互作用总之,该研究揭示了胶质瘤的遗传变异、微环境重塑和细胞通讯等之间的复杂而精细的相互作用及调节机制,为以巨噬细胞为靶点的胶质瘤治疗策略提供了新的见解;对于胶质瘤这种“冷”肿瘤,巨噬细胞分布相当丰富的间充质亚型或PTEN缺失的胶质瘤可能从以巨噬细胞为靶点的药物治疗中获益更多。中山大学肿瘤防治中心倪向荣博士、中山医学院吴维迟博士为共同第一作者,中山大学肿瘤防治中心的陈忠平教授、张继教授、王静教授为共同通讯作者,中山大学数学院孙小强教授为共同第一作者及共同通讯作者。https://www.science.org/doi/10.1126/sciadv.abl5165



